EU-HTA: Europäische Nutzenbewertung (JCA)
Die Herausforderung
Den Herausforderungen des EU-HTA begegnen
Ein zentrales Merkmal der EU-Verordnung ist die gemeinsame klinische Bewertung neuer Medikamente auf europäischer Ebene in Form des sog. Joint Clinical Assessments (JCAs). Die darauf basierende Entscheidung über den Zusatznutzen sowie die Höhe des Erstattungsbetrages obliegt allerdings weiterhin den jeweiligen Mitgliedsstaaten auf nationaler Ebene.
Die deutschen HTA-Behörden - der Gemeinsame Bundesausschuss (G-BA) sowie das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) - haben durch ihre Mitarbeit in diversen Gremien und Planungsgruppen im Rahmen der Arbeiten des Vorbereitungskonsortiums EUnetHTA 21 seit Jahren wesentlichen Einfluss auf die Umsetzung der EU-HTA Verordnung genommen: Sowohl methodische als auch strukturelle Anforderungen in der Umsetzung und Gestaltung des JCA-Prozesses orientieren sich substanziell an dem etablierten deutschen Nutzenbewertungsverfahren.
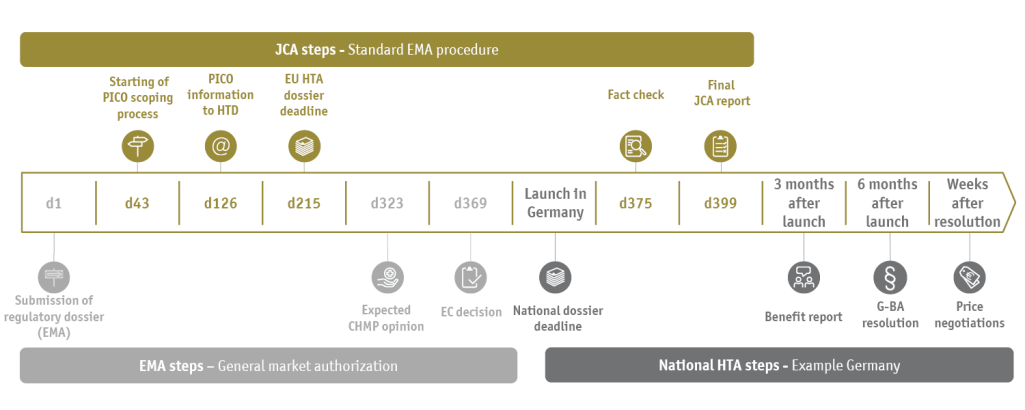
Beim JCA handelt es sich um einen neuen Prozess zur Bewertung klinischer Evidenz auf europäischer Ebene; es steht in gegenseitigem Zusammenhang mit dem Zeitplan der EMA-Zulassung (siehe Abbildung).
Um das Risiko zu minimieren und die Planungssicherheit zu erhöhen, ergeben sich einige wesentliche Fragen für den pharmazeutischen Unternehmer:
- Wie gestaltet sich der JCA-Prozess zeitlich und organisatorisch? Welche Schnittstellen gibt es?
- Wie muss ich den Prozess strategisch und operativ vorbereiten? Welche Funktionen und Expertisen braucht es?
- Wie funktioniert der PICO Scoping Prozess? Welche Szenarien sind realistisch und was bedeuten diese für meinen Gesamterfolg?
- Welche methodischen Anforderungen gelten? Und wie kann ich mich bestmöglich positionieren, falls ich diese nicht erfüllen kann – oder möchte?
- Wie genau erfolgt die europäische klinische Bewertung? Wie kann ich die nationalen Verfahren optimal vorbereiten?
- Wie kann ich die Verfahren auf europäischer und nationaler Ebene effizient koordinieren? Wie reduziere ich die vermeintliche Komplexität und generelle Multifunktionalität?
Die Lösung
Umfassendes Verständnis durch aktive Mitgestaltung des Prozesses
Wir von SKC begleiten die Entwicklung des EU-HTA-Prozesses und des JCA von Anfang an, indem wir uns aktiv im Rahmen von Stakeholdergremien, wie den EUnetHTA 21 Stakeholder Meetings engagieren.
- So haben wir an der Überarbeitung der Deliverables zur methodischen und prozeduralen Ausgestaltung des EU-HTA-Prozesses als einer der aktivsten Meinungsgeber mitgewirkt.
- Als aktives Mitglied innerhalb des Netzwerkes EUCOPE stehen wir zudem in stetigem Austausch mit der pharmazeutischen Industrie und erarbeiten gemeinsam Lösungen für verfahrensmäßige Hürden.
Internationales Netzwerk für europäische Exzellenz nutzen
SKC verfügt über diverse verlässliche strategische und operative Partnerschaften in Europa und weltweit.
- Zum einen arbeiten wir mit nationalen Market Access Agenturen, um bei Bedarf weiterführende lokale HTA und Pricing Expertise in die Überlegungen zur europäischen Gesamtstrategie einfließen zu lassen.
- Darüber hinaus nutzen wir ein alle europäischen Mitgliedstaaten umfassendes klinisches Netzwerk, um etwa bei entsprechenden Fragestellungen z.B. zu relevanten PICOs, unsere Hypothesen durch klinische Erfahrung validieren zu können. Durch die klinische Erfahrung unseres Gründers und Geschäftsführers Univ.-Prof. Dr. med. Matthias Schönermark ist dieses Netzwerk kollegial geprägt und bietet einen bedeutsamen Mehrwert.
- Außerdem arbeiten wir bei Bedarf mit weiteren funktionalen Experten, etwa mit Research Analysten im Bereich Market und Payer Research oder Biostatistikern im Bereich Evidence Strategy.
Experten für den deutschen Market Access – der Blaupause für das JCA
Wir begleiten seit den Anfängen des AMNOG in Deutschland unsere Klienten strategisch und operativ erfolgreich bei der deutschen Nutzenbewertung und Preisverhandlung. Durch den zentralen Einfluss des G-BA und IQWiG sowie den generell ausgeprägten Qualitätsansprüchen und Anforderungen ist das deutsche Verfahren im EU-HTA nun zur Blaupause geworden. Mit unserer umfangreichen Erfahrung im deutschen System und den langjährig gewachsenen, auf gegenseitigem Vertrauen beruhenden Interaktionen mit den deutschen Behörden G-BA und IQWiG, sind wir der perfekte Partner, um unsere Klienten erfolgreich durch den europäischen HTA-Prozess zu begleiten. Besonders zu Beginn der Umsetzung der neuen EU-HTA Rahmenbedingungen ist es wichtig, auf die umfassende Erfahrung im deutschen AMNOG-Prozess zurückzugreifen, um Anpassungen und Implikationen zu antizipieren und Unsicherheiten zu reduzieren.
Agile Arbeitsweise und aktiver Umgang mit Neuerungen und Unsicherheiten
In der heutigen Welt entspricht VUCA – Unbeständigkeit, Unsicherheit, Komplexität, Mehrdeutigkeit – einer maßgeblichen Herausforderung bei der Strategieentwicklung und -umsetzung. Das wird durch eine weitere europäische Ebene nun nochmals verstärkt. SKC nutzt die agile Arbeitsweise, um vermeintlich nicht planbaren Hindernissen und sich ändernden Umständen flexibel zu begegnen. Wir sind uns nachweislich sicher, dass die agile Arbeitsweise durch die hohe Reaktionsfähigkeit und einen stetigen Informationsfluss im Bereich Market Access einen signifikanten Effizienzvorteil bietet.
Unser Ansatz
Als Market Access Special Forces unterstützen wir unsere Klienten dabei, EU-HTA zu meistern.
-
„Fit for EU-HTA Mastery Workshop“ - ist Ihr Produktportfolio fit for EU-HTA?
In unserem Fit for EU-HTA Mastery Workshop analysieren und diskutieren wir gemeinsam die generellen Anforderungen und Erfolgsfaktoren des neuen Prozesses, und evaluieren darauf basierend kollektiv die spezifischen strategischen Implikationen, etwa für ihr Portfolio und ihre Unternehmensstruktur. Der Workshop beinhaltet zudem eine aktive Selbsteinschätzung sowie eine spezifische Auswertung für die jeweiligen Funktionen im Unternehmen. Dieser Ansatz hat sich bewährt um sowohl die notwendige Awareness zu schaffen als auch taktische Maßnahmen im Rahmen der europäischen Gesamtausrichtung nachhaltig anzustoßen.
-
PICO Scoping - Unsicherheiten nehmen
PICO-Schemata (P=Population, I=Intervention, C=Comparator, O=Outcome) definieren jene wissenschaftliche Fragestellungen der klinischen Bewertung, die es mithilfe von statistischen Analysen von Studiendaten im JCA-Dossiers zu beantworten gilt. Hier kann es zwischen den Mitgliedsstaaten fundamentale Unterschiede geben. Je nach zu bewertender Indikation bestehen etwa substanzielle Unterschiede im Versorgungsstandard innerhalb der EU, wodurch der pharmazeutische Unternehmer mehrere und ggf. zahlreiche PICOs mit seinen Studiendaten bedienen muss. Die angeforderten PICO-Schemata werden jedoch erst 100 Tage vor der Einreichung des JCA-Dossiers dem pharmazeutischen Unternehmer bekannt gegeben.
Aufgrund der kurzen Zeitspanne zur Erstellung des europäischen Dossiers besteht ein entscheidender Erfolgsfaktor darin, valide Hypothesen zu den final angeforderten PICOs zu definieren und diese auf die jeweilige Implikation etwa auf die nationalen Preisverhandlungen strategisch zu bewerten. In einer Gap-Analyse wird das Evidenzpaket in Hinblick auf die zu erwartenden Anforderungen formal und strategisch geprüft und entsprechende Optionen zur Schließung der Lücken abgeleitet. Auf diese Weise können Aufwand und Nutzen etwa in Bezug auf die Generierung weiterer Evidenz optimal ausbalanciert werden.
-
Eine antizipierende EU-HTA Strategie entwickeln und umsetzen
Nachdem potenzielle Risiken, Chancen und Handlungsfelder produkt- bzw. klientenspezifisch identifiziert wurden, schließt sich die konkrete Adressierung der Handlungsfelder in Form einer EU-HTA Strategieentwicklung bzw. -umsetzung an. Diese Strategie bezieht bereits zu Beginn die nationalen Preisverhandlungen der einzelnen Mitgliedsländer mit ein. Wir denken immer vom Ziel her: Wie können wir erfolgreich das gewünschte Erstattungsniveau erreichen und dabei das Arzneimittel möglichst vielen Patientinnen und Patienten verfügbar machen.
Gemeinsam mit unseren Klienten entwickeln wir in einem Strategieworkshop eine Roadmap für die Durchführung konkreter Schritte innerhalb der ermittelten Handlungsfelder zur Verbesserung der Erfolgschancen vor und während des EU-HTA. Dabei unterstützen wir sowohl strategisch bei der Bildung von Szenarien als auch operativ bei der tatsächlichen Umsetzung von taktischen Maßnahmen.
Wir begleiten Sie als immer ansprechbarer und zuverlässiger Ansprechpartner auf Augenhöhe durch das EU-HTA-Verfahren.
-
Das JCA-Dossier effizient und strategisch vollständig erstellen
Für das europäische Dossier ist die Zusammenführung großer Datenmengen innerhalb eng getakteter Zeiträume nötig. Dies birgt nicht nur methodische, sondern auch technische Herausforderungen, die es zu lösen gilt. Um den besonderen Anforderungen bei der Erstellung des JCA-Dossiers in 100 Tagen gerecht zu werden, hat SKC einen modularen und AI-unterstützten Prozess entwickelt („JCA100“). Dieser innovative Ansatz basiert auf der statistischen Berechnung der PICO-Datensätze, deren Orchestrierung sowie deren teilautomatisierter Vertextung gemäß den qualitativen Anforderungen des JCAs.
SKC ist mit der Erfahrung aus zahlreichen AMNOG Dossier-Projekten der ideale Partner für die Umsetzung des europäischen Dossiers. Auf Grundlage unserer ausgiebigen Erfahrung im Umgang mit den im internationalen Vergleich hohen methodischen Anforderungen der deutschen Behörden erstellen wir eine den Anforderungskriterien entsprechende Evidenzdarstellung in Verbindung mit einer auf das Produkt zugeschnittenen Value Story.
-
Deltadossier - Das nationale Delta smart nutzen
Das JCA-Dossier enthält alle notwendigen Angaben für eine europäische klinische Bewertung. Auf nationaler Ebene gelten oft weitere bzw. spezifische Anforderungen, etwa in Bezug auf die Kosten der Vergleichstherapien oder die Kosteneffektivität der neuen Therapie. Diese Aspekte werden in einem nationalen Dossier zusätzlich bereitgestellt. Als Schnittstelle der europäischen zur nationalen Preisstrategie und als entscheidende Gelegenheit zur Verankerung der nationalen Value Story ist dieses „Delta“-Dossier von erheblicher taktischer Bedeutung. Wir unterstützen unsere Klienten sowohl bei der Beratung als auch bei der Erstellung der notwendigen Dokumente.
-
Die europäische Bewertung und die nationale Verhandlung optimal abstimmen
Um die optimale strategische Ausrichtung für die nationale Nutzenbewertung und die Preisverhandlungen zu erreichen, muss die Strategie über das JCA hinausgedacht werden. Die gemeinsame klinische Bewertung nach multiplen PICO-Schemata kann Risiken und Chancen hervorbringen, welche der pharmazeutische Unternehmer für erfolgreiche nationale HTA-Verfahren strategisch berücksichtigen sollte. Zur optimalen Vorbereitung der nationalen HTA-Verfahren analysieren wir die Implikationen des JCA-Reports für die nationalen Bewertungsverfahren und anschließenden Preisverhandlungen. Durch die strategische oder operative Begleitung oder Leitung von über 80 Preisverhandlungen in Deutschland wissen wir, dass eine frühe Strategieentwicklung entscheidend für die Basis der nationalen Preisverhandlungen und damit einen erfolgreichen Market Access ist.
Kontaktieren Sie uns

Gründerin und Geschäftsführerin
Fax: +49 511 64 68 14 – 18