Neue Wege in der Erprobung von medizintechnischen Produkten
Veränderung des § 137e SGV und die Implikationen hieraus
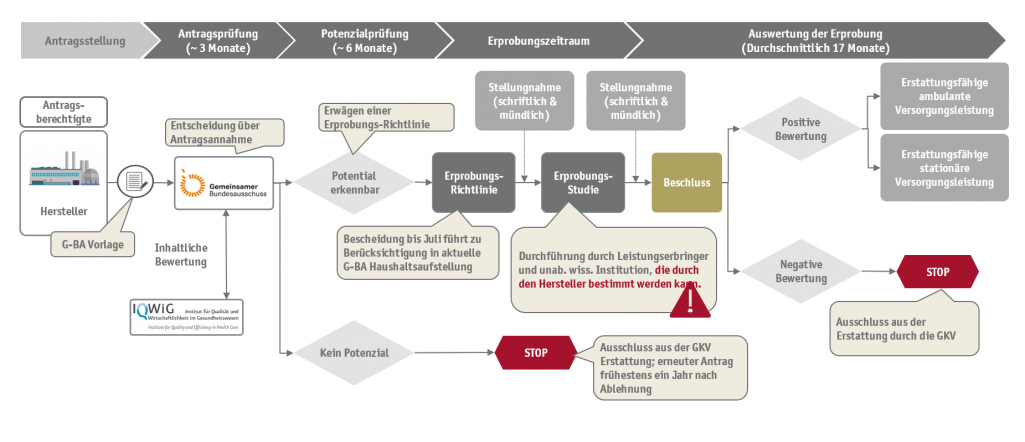
Zurückblickend war der wesentliche Hintergrund der Einführung der Erprobungsregel, dass medizintechnische Innovation einen schnelleren Einzug in die regelhafte Erstattung erhalten und aufwendige Bewertungsverfahren wie ein NUB-Verfahren. §135 SGB V vermieden werden konnten. Doch bereits die ersten Jahre nach der Implementierung in 2012 zeigten, dass mit dem Verfahren einige bürokratische und aufwendige Hürden zu nehmen sind. So schaffte es erst 2017 die erste Erprobungsregel auf den Weg gebracht zu werden, insg. mehr als 5 Jahre nach dem eigentlichen Inkrafttreten.
Neben kleineren Erneuerungen in der Verfahrensweise sind mit der Gesetzesänderungen nun auch die an dem Erprobungsverfahren beteiligten Medizinprodukthersteller berechtigt selbst unabhängige wissenschaftliche Institution auf eigene Kosten mit der wissenschaftlichen Begleitung und Auswertung der Erprobung zu beauftragen. Gemäß der neuen Verfahrungs-ordnung müssen die in Eigeninitiative vergebenen Studienkonzepte dem G-BA zur Prüfung vorgelegt werden. Ebenfalls muss der Hersteller belegen, dass eine entsprechende Einflussnahme auf die unabhängige wissenschaftliche Institution ausgeschlossen werden kann. Die bisherigen Verfahrensweisen bleiben des Weiteren bestehen. Auch der G-BA kann nach wie vor eine unabhängige Institution bestimmen, jedoch kann ein Hersteller hier bereits nach Potentialfeststellung das eigene Konzept und die kooperierende Institution vorstellen und das Verfahren wahrscheinlich erheblich beschleunigen.
Entsprechende Änderungen wurden nun im siebten Abschnitt des zweiten Kapitels der VerfO - die Durchführung und Finanzierung der Erprobung medizinischer Methoden implementiert, womit die Bestimmungen ab sofort gültig sind. Die Regelung kann rückwirkend für alle Verfahren genutzt werden, die bis zum 11. Mai 2019 mit der Erprobung starteten. Ob die Änderung zu einer wesentlichen Beschleunigung führt ist bislang nicht abschließend zu bewerten, jedoch werden mit der Gesetzesänderung die bürokratischen Hürden im Verfahren zumindest teilweise reduziert, welches die Attraktivität für Medizinprodukthersteller wieder steigern könnte. SKC berät umfassend entlang der Erprobung neuer Untersuchungs- und Behandlungsmethoden und unterstützt Sie bei Beratungsanfragen zur Potentialbewertung und der Antragsvorbereitung.