Zweiter offener Aufruf von EUnetHTA zur Beantragung von Joint Scientific Consultations
Europäische Verordnung über die Bewertung von Gesundheitstechnologien
Angesichts dieses Zeitplans sollten klinische Studien der Phase II und/oder III für Arzneimittel, deren europäische Zulassung ab 2025 erwartet wird, bereits jetzt gemäß den neuen Anforderungen der EU-HTA-Verordnung geplant werden. Da die Veröffentlichung vieler Richtlinien-Dokumente noch aussteht, ist die Teilnahme an einem Beratungsgespräch von besonderer Bedeutung.
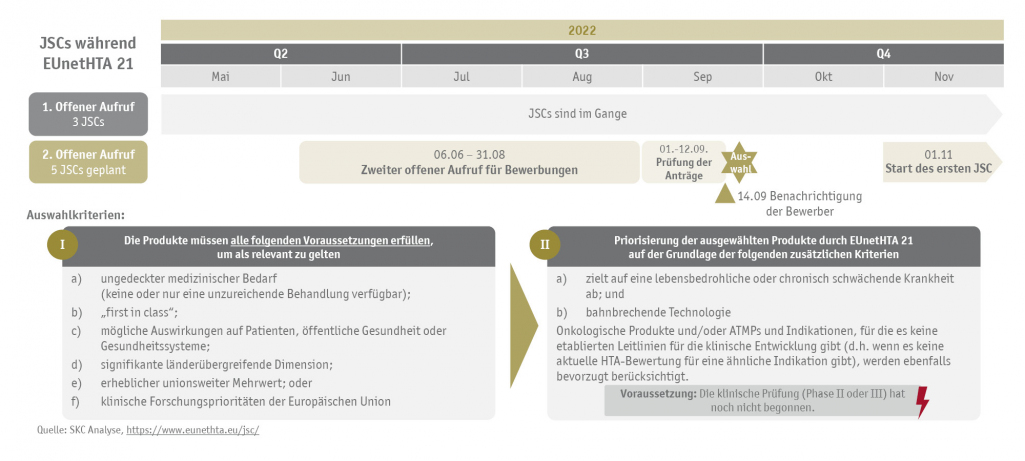
Bis die Verordnung umgesetzt ist, ist das EUnetHTA 21-Konsortium damit beauftragt, bis September 2023 sechs bis acht gemeinsame Beratungsgespräche (Joint Scientific Consultations (JSC)) durchzuführen. Drei Arzneimittel wurden bereits für ein Beratungstreffen ausgewählt und ihre JSCs laufen derzeit. Der zweite offene Aufruf zur Einreichung von Bewerbungen für die verbleibenden maximal fünf JSCs beginnt am 6. Juni 2022 und endet am 31. August 2022.
Für die Auswahl von Arzneimitteln, die für ein JSC in Frage kommen, gelten folgende obligatorische Kriterien:
- ungedeckter medizinischer Bedarf (keine oder nur eine unzureichende Behandlung verfügbar)
- „first in class"
- mögliche Auswirkungen auf die Patienten, die öffentliche Gesundheit oder die Gesundheitssysteme
- signifikante länderübergreifende Dimension
- erheblicher unionsweiter Mehrwert oder
- klinische Forschungsprioritäten der Europäischen Union
Anschließend erfolgt eine Priorisierung der Anträge durch EUnetHTA 21 auf der Grundlage der folgenden zusätzlichen Kriterien:
- zielt auf eine lebensbedrohliche oder chronisch schwächende Krankheit ab und
- bahnbrechende Technologie
Onkologische Produkte und/oder ATMPs und Indikationen, für die es keine etablierten Leitlinien für die klinische Entwicklung gibt (d.h. wenn es keine aktuelle HTA-Bewertung für eine ähnliche Indikation gibt), werden ebenfalls bevorzugt berücksichtigt.
Die folgende Grafik verdeutlicht den Prozess für Joint Scientific Consultations während EUnetHTA 21:
Falls Ihr Unternehmen derzeit eine Phase-II- und/oder Phase-III-Studie für ein Produkt plant, das diese Kriterien erfüllt, oder falls Sie sich nicht sicher sind, ob Ihr Produkt die Kriterien erfüllt, freuen wir uns von Ihnen zu hören. Auch besprechen wir mit Ihnen gerne die Möglichkeiten einen bereits gebuchten EMA Scientific Advice in ein paralleles EMA/EUnetHTA 21 JSC umzuwandeln. Wir von SKC freuen uns darauf, unsere Klienten bei der Beantragung, Vorbereitung, Durchführung und Nachbesprechung eines JSCs in unserer bekannten Art als strategischer Berater und Sparringspartner zu unterstützen!
Quellen:
EU-HTA regulation
EUnetHTA 21