EUnetHTA 21 Ergebnisse
Fristen zur Einführung eines künftigen EU-HTA-Systems
Das EUnetHTA 21-Konsortium besteht aus den folgenden nationalen HTA-Gremien unter der Leitung des ZIN (Niederlande):
- AEMPS (Spanien)
- AIFA (Italien)
- AIHTA (Österreich)
- G-BA (Deutschland)
- HAS (Frankreich)
- INFARMED (Portugal)
- IQWIG (Deutschland)
- KCE (Belgien)
- NCPE (Irland)
- NIPN (Ungarn)
- NOMA (Norwegen)
- TLV (Schweden)
- ZIN ( Niederlande)
Seit seiner Gründung im September 2021 knüpft EUnetHTA 21 an die Ergebnisse und Erkenntnisse der vorangegangenen Projekte an und konzentriert sich darauf, ein zukünftiges EU-HTA-System zu schaffen. Dies ist dringend notwendig, da die europäische Verordnung über HTA (EU-HTA regulation) am 11. Januar 2022 in Kraft getreten ist und tertiäre Rechtsakte sowie Leitfäden derzeit nicht verfügbar sind.
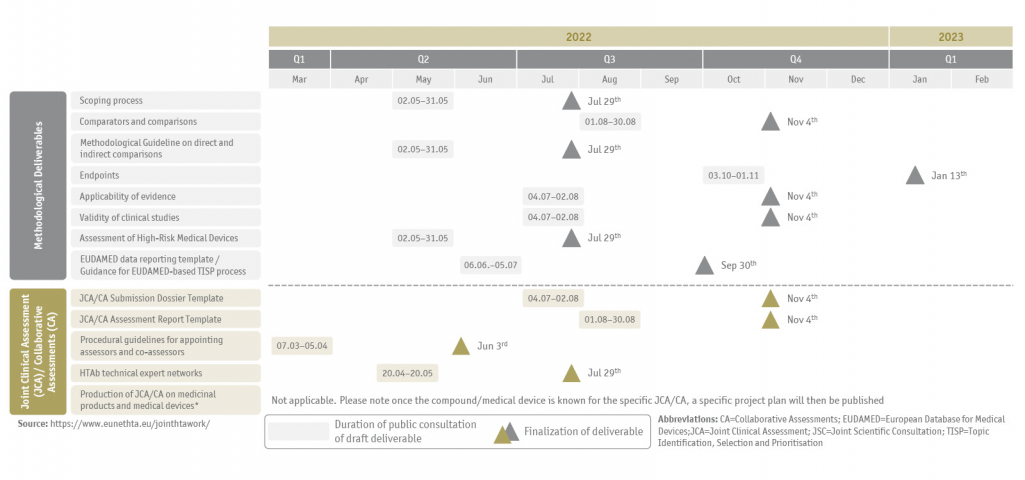
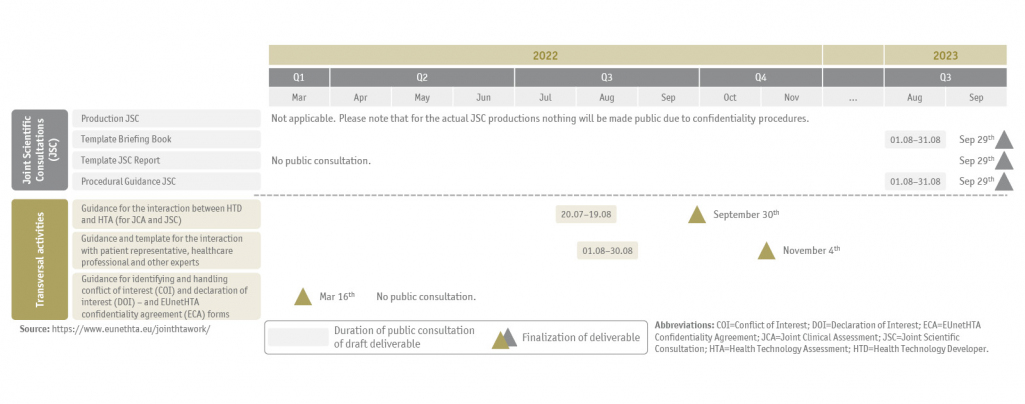
Alle zu erbringenden Ergebnisse, der aktuelle Zeitplan für die öffentliche Konsultation und die Fertigstellung der Entwürfe sind nachstehend zusammengefasst (Abbildung 1 und 2) und werden auf der EUnetHTA-Webseite regelmäßig aktualisiert.
Zeitpläne für den Projektverlauf von EUnetHTA
Die SKC Beratungsgesellschaft verfolgt die Entwicklung der Leitliniendokumente aufmerksam und beteiligt sich aktiv an den öffentlichen Konsultationen. So haben wir am 30. Mai 2022 unsere Kommentare zu den Entwürfen der Teilziele D4.2 Scoping-Prozess und D4.3.2 Methodischer Leitfaden zu direkten und indirekten Vergleichen eingereicht. Wenn Sie an unserer Stellungnahme zu den Entwürfen der Teilziele interessiert sind, würden wir uns freuen, von Ihnen zu hören und stellen Ihnen auf Anfrage gerne unsere schriftliche Stellungnahme zur Verfügung.
Wir ermutigen alle Beteiligten, sich ebenfalls einzubringen, um einen möglichst reibungslosen Übergang von nationalem zu europäischem HTA zu ermöglichen und eine klare und effektive Leitlinie für die europäische Bewertung von Gesundheitstechnologien zu gewährleisten.
Quellen: