Zeitlicher Ablauf der EU-HTA Nutzenbewertung enger getaktet als vermutet
Update zum Joint Clinical Assessment (JCA) Zeitplan
Erster Entwurf für die konkrete zeitliche Ausgestaltung
Dieses wird aufgrund einer Vielzahl an verschiedenen PICO (Patient, Intervention, Comparator, Outcomes)-Schemata, zu denen vom Hersteller Daten vorgelegt werden müssen, deutlich größer und aufwändiger ausfallen als Dossiers auf nationaler Ebene. Auf diese Unsicherheiten zum Zeitrahmen der europäischen Bewertung hat EUnetHTA21, das Konsortium nationaler HTA-Gremien, welches bis zum September dieses Jahres mit der Vorbereitung des EU-HTA Prozesses beauftragt ist, mit der Einrichtung einer „Hands-On Group on Timelines for Joint Clinical Assessments (JCAs)" reagiert. Diese hat nun den ersten Entwurf für die konkrete zeitliche Ausgestaltung des europäischen Bewertungsverfahrens veröffentlicht.
Zwei Szenarien
Dass der europäische HTA-Prozess eines neuen Arzneimittels vor allem von der Timeline seiner Zulassung durch die European Medicines Agency (EMA) abhängt, ist bereits in der EU-HTA Verordnung festgehalten. Hier schreibt der Gesetzestext in Bezug auf den zeitlichen Ablauf vor, dass das europäische Nutzenbewertungsdossier spätestens 45 Tage vor dem erwarteten Erscheinen der Committee for Medicinal Products for Human Use (CHMP)-Opinion vom Hersteller eingereicht werden muss. Im Entwurf der Hands-On Group wird nun abhängig von der Art des EMA-Prozesses zwischen zwei Szenarien unterschieden:
- einem JCA im Rahmen eines Standardverfahrens der EMA für neue chemische Wirkstoffe (New Chemical Entities; NCEs) und
- einem JCA im Rahmen eines beschleunigten Zulassungsverfahren bzw. für Type-II-Änderungen (z.B. Indikationserweiterungen).
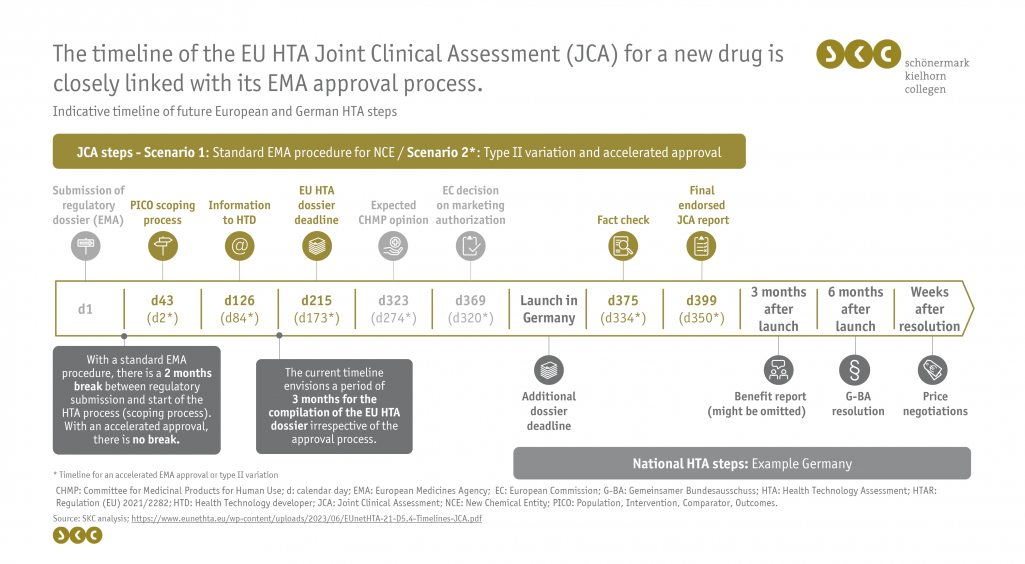
Der zeitliche Ablauf der Bewertung ist für beide Szenarien in der nachfolgenden, englischen Abbildung anhand der wesentlichen Prozessschritte dargestellt.
Die europäische klinische Bewertung beginnt mit der Einreichung des regulatorischen Zulassungsdossiers bei der EMA (Tag 1). Die Koordinierungsgruppe initiiert daraufhin den Scoping-Prozess, welcher bei einem Standardverfahren erst 42 Tage später beginnt, bei einem beschleunigten Zulassungsverfahren oder einer Typ-II-Änderung jedoch direkt initiiert wird. Das Ergebnis des Scopings wird den pharmazeutischen Unternehmer etwa nach 2,5 Monaten kommuniziert (Tag 126 bzw. Tag 84), womit der knappe Zeitraum für die Erstellung des europäischen Nutzenbewertungsdossiers beginnt. Auffällig ist hierbei der bei beiden Szenarien gleich kurz bemessene Zeitraum von 3 Monaten von der Bekanntgabe der Informationen aus dem Scoping-Prozess zu den PICO-Schemata bis zur Einreichung des EU-HTA Dossiers (Tag 215 bzw. Tag 173). Hätte die Hands-On Group, wie durch den Gesetzestext ermöglicht, die spätestmögliche Deadline von 45 Tagen vor der CHMP-Opinion für die Einreichung des Dossiers herangezogen, betrüge die Zeit zur Erstellung des Dossiers etwa 5 Monate.
Mit der erteilten Zulassung ist der Launch des Arzneimittels in Deutschland möglich, woraufhin auch die nachgelagerte nationale Nutzenbewertung startet. Innerhalb von 30 Tagen nach der Zulassung wird der finale europäische Bewertungsbericht (JCA-Report) zur Kontrolle auf faktische Fehler an den Hersteller übergeben und anschließend etwa 11 bis 13 Monate nach initialer Einreichung der Zulassungsdokumente final veröffentlicht.
Die Unsicherheit bleibt
Obwohl es für die Planungssicherheit pharmazeutischer Unternehmen in Bezug auf den EU-HTA-Prozess von hohem Wert ist, erste Erkenntnisse über dessen zeitlichen Ablauf zu erhalten, handelt es sich bei der vorliegenden Timeline jedoch vorerst um einen Entwurf. Dieser steht unter anderem bei einem Treffen von EUnetHTA21 mit der pharmazeutischen Industrie am 13. Juli 2023 zur Diskussion. Des Weiteren sind eventuelle Neuerungen der EMA-Zulassungsabläufe durch die Anpassung der EU-Pharma Legislation ebenfalls noch nicht berücksichtigt.
SKC hält Sie über diese und alle weiteren relevanten Entwicklungen bezüglich des EU-HTA-Prozesses weiterhin kontinuierlich auf dem Laufenden. Wenn Sie daran interessiert sind, die Implikationen des veröffentlichten EU-HTA-Zeitrahmens für den Marktzugang ihres Produktes zu erörtern oder Sie nach Möglichkeiten für die Erstellung des EU-HTA-Dossiers unter den gegebenen zeitlich kritischen Bedingungen suchen, nehmen Sie gern Kontakt mit uns auf. We are the market access special forces.
Quellen:
Über den Autor

Senior Medical Writer
M.Sc. Drug Research and Development
Fax: +49 511 64 68 14 – 18