Orphan Drugs in Deutschland
Medikamente für seltene Erkrankungen, sog. orphan drugs, und ihre spezifischen Herausforderungen beim Market Access zählen zu unseren Kernkompetenzen.
Der Marktzugang von Arzneimitteln für seltene Erkrankungen (sog. orphan drugs) ist in Deutschland mit besonderen Herausforderungen verbunden, die sich dem Hersteller aufgrund der Seltenheit der Erkrankung (z. B. kleine Populationsgröße, Studien mit geringerem Evidenzgrad) stellen. Infolgedessen bestehen erhebliche Unsicherheiten hinsichtlich des Mehrwerts des Medikaments, was zu intensiven Preisverhandlungen mit hohen Rabatten führen kann. Pharmazeutische Unternehmen, die die Einführung neuer orphan drugs auf dem deutschen Markt planen, sollten deshalb frühzeitig eine solide Strategie ausarbeiten, um einen erfolgreichen Markteintritt zu gewährleisten.
Die SKC Beratungsgesellschaft ist eine strategische Beratung mit dem Fokus, innovative Produkte durch die herausfordernde Market Access-Landschaft zu steuern und erfolgreich auf den Markt zu bringen.
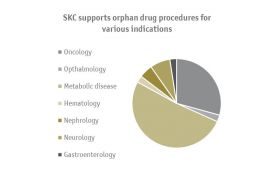
Als "market access special forces" sind wir auf die strategischen Herausforderungen von Orphan Drugs, ATMPs, repurposed drugs und Produkten, die das Behandlungsparadigma verändern, spezialisiert. Wir sind an jedem 5. Orphan Drug AMNOG-Verfahren beteiligt (52 von insgesamt 248 AMNOG-Verfahren, Stand Mai 2023).
Orphan Drugs sind ein zentrales Thema unserer Veröffentlichungen. Darüber hinaus produzieren und veröffentlichen wir den Podcast "Der Profcast - Seltene Erkrankungen und ihre Therapien", der sich mit den besonderen Umständen von Patienten mit seltenen Erkrankungen, der damit in Zusammenhang stehenden Medizin und den Herausforderungen für Forschung, Entwicklung, Ökonomie und Erstattung auseinandersetzt. Nachstehend finden Sie eine Auswahl unserer jüngsten Veröffentlichungen.
Unsere Mission

Whitepaper, Publikationen and Blogs

SKC Podcast (2022/23):

Blog (2022):

SKC Whitepaper (2021)
Orphan drugs in Germany - Lessons learned from 10 years AMNOG, best and worst practices

Publikation (2021)

SKC Whitepaper (2020)
Registry requirements for the German Benefit Assessment of pharmaceutical products

Publikation (2019)
Orphan Drugs nach GSAV - Neue Rahmenbedingungen bei Zulassung und Erstattung
Publikation (2018)
Orphan drugs' market access challenges in Europe from a German perspective